疗效超瑞德西韦,重症治疗组零死亡,中美联手新冠研究重磅发现!


独家抢先看
文/一节生姜( 病理及实验医药系研究副教授 特邀撰稿员)
核心提要
1. 药物芦可替尼(Ruxolitinib)在中国的小规模临床试验获得成功,由20名重症新冠肺炎患者组成的治疗组达到“零死亡”。
2. 过激免疫反应是新冠患者死亡的重要因素,而芦可替尼可抑制“细胞因子风暴”,降低死亡率。
3. 血液病领域专家黄刚和周剑锋的合作促成了试验的成功,芦可替尼成为目前世上唯一具有数据和文章的特效药。
4. 尽管试验证实芦可替尼能挽救无免疫缺陷的新冠肺炎重症患者的生命,但其大规模的临床试验和应用尚在探索。
临床试验结果:治疗组出现“零死亡”
5月27日,国际医学杂志《过敏及临床免疫学杂志》发表了一份在中国进行的临床研究结果:在使用一个叫做芦可替尼(Ruxolitinib)的药物进行治疗后,重症新冠肺炎患者出现“零死亡”,而使用正常标准治疗的对照组,死亡率为14.3%。
在所有的新冠病毒感染者里,80%都只有轻型或者普通型症状,只有20%的患者属于重症、危重症,而死亡事件,也主要来自于重症、危重症患者。
谁解决了重症、危重症的治疗,谁就是“人民的希望”!
如果说这个研究有什么遗憾,那就是入组的患者太少:治疗组20人,对照组21人。对照组出现的死亡人数是3人。在对照组中,总共有4人在治疗过程中转入重症监护(ICU),除了已经死亡的3人,还有一人目前还在靠ECMO(人工肺)维持生命。
重症新冠肺炎患者的死亡率,是一个直观的疗效指标。但是对于一个小规模的临床试验来说,尽管治疗组达到了“零死亡”,但要显示出统计学上的显著性,患者人数不允许。
作为一个正式的临床试验,必须预先设立评估疗效的主要指标,如果能达到明显改善,试验即达到“主要疗效终点”。因为新冠肺炎没有什么特效药,临床研究的主要指标一般都不会选择死亡率,而是使用一个综合的“临床症状”指标,即对患者能否正常活动,是否需要住院、吸氧、插管、ECMO(人工肺),是否出现死亡等各方面的情况进行评估,给出一个量化的评分,比较治疗前后评分是否有变化。
芦可替尼的临床试验,设计时制定了两个主要考察指标,其中一个是上述的临床症状评分,另一个专门针对肺炎的指标:肺部CT扫描结果。只要有一个指标得到明显改善,临床试验便可获得成功。
这两个主要指标到底有什么变化呢?
与对照组相比,芦可替尼组患者可以在较短时间内获得临床症状改善,对比中位数改善时间,芦可替尼组12天,而对照组15天。在治疗7天后,芦可替尼组有20%出现好转,而对照组只有9.5%。在这个指标的考察上,芦可替尼虽然有优势,但因入组人数太少,优势在统计学上不显著。
对于肺部CT扫描结果,在治疗7天后,两组患者的差别就很大,但因为部分患者此时无法进行CT扫描,数据不完整,因此只能用治疗14天后的数据:芦可替尼组有90%的患者出现了明显改善,而对照组只有61.9%,两组差异显著。
所以,在CT结果这个指标上,芦可替尼临床试验达到了主要终点,获得了成功。
在如今的新冠治疗临床试验中,出现“对照组有死亡,治疗组零死亡”的,除了芦可替尼的这个研究,目前只有意大利的一个临床试验,试验的药物是抗GM-CSF受体抗体,但目前并未正式发布结果。
这篇研究文章的共同通讯作者,分别为黄刚,辛辛那提儿童医院医学中心的肿瘤病理学助理教授,同济医学院的周剑峰教授。这可能是目前中美两国科学家合作的一个新冠病毒药物的突破性成果。
新冠病毒会引发患者“细胞因子风暴”
芦可替尼做为JAK抑制剂 ,专治这病?
为什么JAK抑制剂可以用来治疗新冠肺炎呢?
芦可替尼是个可以口服的小分子抑制剂,能够特异性抑制酪氨酸激酶JAK。 在2011年和2014年,芦可替尼先后获得美国FDA 批准, 用于治疗骨髓纤维化和真性红细胞增多症。这些疾病都跟JAK激酶活性过高有关。
2月18日,权威医学杂志《柳叶刀呼吸医学》在线发布了全球首份新冠肺炎(COVID-19)患者病理报告[1]。患者的双肺都有呼吸窘迫综合征(ARDS),双侧肺泡都有损伤,伴有细胞性的纤维黏液样渗出物。双肺可见间质单核炎性细胞浸润,以淋巴细胞为主。
患者感染病毒之后,免疫细胞会对病毒发起攻击。如果免疫系统能够有效地控制住病毒的感染,那患者只会出现轻症,甚至无症状。 但是对于重症患者来说,由于病毒感染不能够被迅速、有效地控制,或者即便病毒已经被控制了,病毒核酸检测已经转阴,但是病毒感染造成的伤害还是会带来错觉,让免疫系统误认为病毒还是在攻击,于是继续派遣一些特别的免疫细胞进入肺部。
新冠肺炎患者尸检证明,患者肺部富集一种叫做“巨噬细胞”的免疫细胞[2]。这些免疫细胞在激活之后,会释放很多“细胞因子”,以召集更多的免疫细胞小伙伴来攻击入侵者。
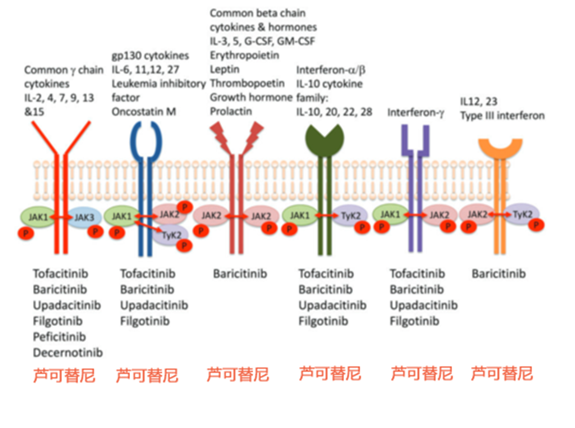
细胞因子的作用方式是与免疫细胞表面的受体结合。大量的细胞因子,比如IL-2, IL-4, IL-6, G-CSF 等等,在与受体结合之后,就会导致下游的JAK激酶活化(包括JAK1, JAK2, JAK3, TyK2)。
图:很多细胞因子都能激活JAK,JAK抑制剂可以终止细胞因子的信号(图片来自文献[3])
而JAK激酶活化之后,又会导致免疫细胞制造并释放出更多的细胞因子。
细胞因子导致JAK激活,而激活的JAK,又可以导致更多的细胞因子,这样一个不断升级的循环,使得细胞因子释放得越来越多,就出现了“细胞因子风暴”。风暴越强烈,说明免疫越过激。
新冠病毒感染后,出现的严重肺炎及呼吸窘迫症,都跟“细胞因子风暴”和免疫过激有关。免疫杀伤就像一把刀,可以杀伤病毒,也可以杀伤正常的组织。尤其在出现过激免疫反应的时候,对正常组织的伤害非常严重。
要对付这样的细胞因子风暴,可以使用拮抗某个细胞因子的药物,如针对IL6的托珠单抗,但由于不只是一个细胞因子在搞事,不见得能够制止所有的细胞因子风暴。
因为大多数细胞因子都要通过激活JAK才能起效,直接守住JAK这个关口,可以“一夫当关,万夫莫开”。
使用JAK抑制剂来对抗细胞因子风暴,也就有“一剑封喉”的效果。
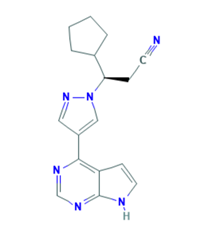
图:芦可替尼(ruxolitinib)
芦可替尼对JAK1和JAK2都有很好的抑制活性,应该是一把“好剑”。
芦可替尼在新冠肺炎缺氧状态,
会起到制氧作用?
在有关新冠肺炎的报道中,大家比较常听到的一个词汇,是血氧饱和度 。人体的正常血氧饱和度,是95%以上。
缺氧是患者诊断为重症、危重症的一个重要指标。 根据国家卫生健康委员会所发布的 《新型冠状病毒感染的肺炎重症、危重症病例诊疗方案(试行)》,如果血氧饱和度不到93%,或者出现呼吸困难的情况,比如呼吸频率增快(≥30次/分)、口唇紫绀等,就属于重症。如果检测重症患者的动脉血氧分压(PaO2),应该会低于300mmHg。
因为缺氧,重症患者需要吸氧,也就是使用无创呼吸机辅助通气。如果是出现了呼吸衰竭,那就是危重症了,需要使用有创机械通气,即气管插管,甚至上ECMO 机(人工心肺机)。
前面说细胞因子风暴可以导致JAK激活,但是在低氧状态下,肺动脉平滑肌细胞中JAK 表达也会增加,活性增高。2005年的一个细胞实验表明,在缺氧之后,肺动脉平滑肌细胞中JAK1,JAK2和JAK3的基因表达都增加了,在8小时后达到高峰,同时JAKs-STATs信号传递通路会被激活,说明JAK可能参与了缺氧所导致的肺动脉平滑肌损伤的发病机制[4]。
平滑肌在血管壁里,控制血管的收缩和舒张,如果缺氧使得平滑肌里的JAK过于活跃,从而使得血流不舒畅,那么JAK抑制剂也可以缓解这个问题。 当然,到底是细胞因子风暴导致缺氧,还是缺氧加剧了细胞因子风暴,目前没有一个明确的答案。
“细胞因子风暴”会导致患者的肺部纤维化
芦可替尼或可起到刹车作用
芦可替尼是否通过抑制细胞因子风暴达到治疗效果呢?这可以通过患者血清中48种细胞因子在治疗前后的变化来说明。
在使用芦可替尼治疗的第三天,患者48种细胞因子的所有平均值均下降,其中有7种细胞因子明显降低 (IL-6,NGF-β, IL-12, MIF,MIP-1α, MIP-1β,VEGF)。相比之下,在对照治疗组,虽然大部分细胞因子的平均值有所下降,但下降幅度大多不明显,有4种细胞因子反而增加( MIP-1α, G-CSF, IFN-a2和 IL-1a)。
所以,从血清中细胞因子水平的变化,可以清楚表明芦可替尼达到了抑制细胞因子风暴的效果。
从某种意义上来说,“细胞因子风暴”也是免疫系统用来清除病毒感染的暴风雨,如果芦可替尼抑制了“细胞因子风暴”,会不会影响病毒的清除呢? 研究结果发现,芦可替尼治疗并不改变病毒的转阴速度,也不改变患者体内抗病毒IgM、IgG抗体的产生,所以不必要担心芦可替尼会延迟机体对病毒的清除。
值得一提的是,芦可替尼治疗缩短了淋巴细胞的恢复时间。淋巴细胞减少,与新冠肺炎患者预后较差有相关性。在临床试验开始时,对照组和芦可替尼组分别有9例和12例患者出现淋巴细胞减少症,使用对照治疗后,淋巴细胞恢复中位数时间为8天,而使用芦可替尼治疗后,这个时间缩短为5天,说明淋巴细胞能在更短的时间内恢复。
目前的研究发现,患者体内淋巴细胞恢复,与病毒清除有相关性。在一个对25例新冠肺炎患者的调查中,经过8~14天的治疗后,出现病毒转阴的患者,淋巴细胞的恢复都比较好 [5]。
此外,“细胞因子风暴”还会导致患者的肺部纤维化,这是新冠肺炎幸存者中可能遇到的长期问题。在使用芦可替尼治疗后,应该可以减少肺纤维化,不过目前还没有相关数据,需要长期随访观察才能获得。
如今新冠肺炎治疗的问题,就是重症的治疗问题,如果JAK抑制剂能把细胞因子风暴的问题解决了,目前的问题就解决了。
不仅如此,这对于未来也很重要。由于新冠肺炎已经在全世界大流行,新冠病毒成为季节性传染病的可能性越来越大,大家对疫苗的期望越来越高,认为只有靠疫苗来终结病毒。
但是,之前用猴子所做的动物实验发现,在接种S蛋白制造的SARS疫苗之后,虽然可以加快猴子对病毒的清除,但肺部病理检查结果却表明,打了疫苗的猴子肺部还是有病理变化,而且竟然比没打疫苗的更严重[6]。
虽然新冠病毒与SARS 有所不同,但是由于两种病毒的S蛋白同源,感染机制也相同,新冠疫苗也可能出现类似的结果,因此有必要对此做好心理准备。目前认为疫苗的这个副作用,是由于“抗体依赖性毒性增强”(ADE),而这个毒性的核心,也是细胞因子风暴。所以,如果未来疫苗临床试验或者正式使用中出现了ADE,也可使用芦可替尼来解决问题。
芦可替尼抗细胞因子风暴:
长期基础研究的成果
为什么会想到使用芦可替尼来作为细胞因子风暴的终结者呢?这要从文章的共同通讯作者黄刚说起。
黄刚是辛辛那提儿童医院医学中心的肿瘤病理学助理教授。黄刚1991年毕业于北京大学生命科学院,之后于2001年毕业于日本京都大学,获得博士学位。黄刚教授的重点研究方向,在于肿瘤表观遗传学调控和小鼠疾病模型的构建。
图:黄刚于武汉东湖(2019年11月18日)
黄刚教授的领域,是血液病研究,具体是噬血细胞性淋巴组织细胞增生症(HLH)。这是一种致命的疾病,特点就是免疫过激,目前的一线治疗方案,主要是使用糖皮质激素和化疗,但治疗之后复发率很高。
在研究HLH致病机理的过程中,黄刚对该疾病的特征性基因表达进行了分析,发现与“缺氧诱导因子”(HIF)有关的基因表达增加了。 从名字就能了解到,HIF的表达受缺氧影响,黄刚的这个发现,说明这种疾病可能跟“缺氧”有关。
为了更好地研究对HIF的诊断和治疗,黄刚构建了一个小鼠疾病模型。这是一种特殊的转基因小鼠,在被“淋巴细胞脉络膜脑膜炎病毒”感染之后,就会诱导产生HLH症状,而在生病的小鼠里,也能检测到更多的HIF表达。如果直接构建转基因小鼠,让它们的造血细胞中表达HIF,同样可以导致类似HLH的症状:严重贫血、血小板减少、脾肿大和多器官衰竭。如果检查出现HLH的这些小鼠,可以观察到激活的巨噬细胞和失调的自然杀伤细胞[7]。
不但HLH跟“缺氧”有关,黄刚还有一个更重要的发现:只要同时大量表达两种细胞因子,就可以让小鼠出现HLH的症状。由于这些细胞因子都导致JAK的激活,如果使用JAK抑制剂芦可替尼,就可以救治生病的小鼠。
新冠病毒爆发前,2019年11月,黄刚去武汉参加了一个学术会议。之后不久,新冠肺炎就在武汉爆发了。因为新冠肺炎患者出现呼吸窘迫综合征,这很可能与细胞因子风暴所导致的肺损伤有关。患者自带的免疫系统,可以对付病毒的感染,也许患者真正需要的医学帮助,是缓解免疫过激所带来的伤害。
黄刚与国内华中科技大学同济医学院的周剑峰教授,是长期的合作者。周剑峰教授身处疫情的重灾区——武汉,与其他一线的临床医生一样,迫切需要尝试各种可能的治疗方案。
于是,合作团队谨慎提出了控制细胞因子风暴的方案。这需要在重症患者中,先确认一些细胞因子的表达水平是否比较高,再针对性地进行治疗,或使用抗细胞因子的抗体,或使用芦可替尼。
作为临床试验的负责人,周剑峰教授提交了临床研究的申请,准备对患者的细胞因子水平进行分析,因为时间比较急迫,也同时登记注册了一个治疗性的临床试验,使用芦可替尼来治疗重症新冠肺炎患者。
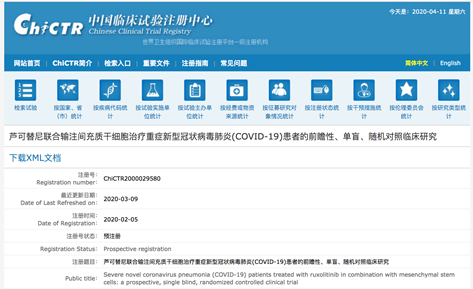
这个临床试验注册使用的题目是:“芦可替尼联合输注间充质干细胞治疗重症新型冠状病毒肺炎(COVID-19)患者的前瞻性、单盲、随机对照临床研究”,但是在正式开始后,治疗方案经过了修改,简化为仅用芦可替尼来治疗。
全球共有三个研究细胞因子风暴试验
均出现“零死亡”
周剑峰教授是国内临床血液肿瘤领域具有影响力的专家,参与制定了多项血液肿瘤中国临床诊疗指南,现任中华医学会血液分会委员,实验诊断学组副组长,中国抗癌协会血液分会常委,中国基因治疗协会委员,中国实验血液学会委员。
(图片来自网络:“救命侠客”周剑峰)
与黄刚一样,周剑峰的研究领域也主要是血液病。黄刚偏向基础研究,而周剑峰偏向临床,所以两人的研究正好互补,是长期的合作伙伴。
新冠病毒感染,本来属于传染病、感染性疾病,与血液病有八杆子打不着的关系。新冠病毒感染之后,大家从新闻中也时常听到患者出现肺损伤、心脏损伤、肾脏损伤等等,对于这样多器官损伤的疾病,各个领域的专家都会第一时间提出自己的治疗方案。
如果不是因为武汉的病床不够用,新冠肺炎感染者也许不会进入周剑峰教授所在血液病病房。所以,从某种意义上来说,如果芦可替尼是一个奇迹,那这个奇迹也是拜新冠疫情所赐。
这个临床试验本来计划入组70名患者,从2月9日开始在同济医学院招募患者,后来又在武汉第一人民医院、湘雅继续招募了一些患者,到2月28日为止,总共实际入组了41名患者。在2月底以后,随着中国的疫情好转,已经很难再继续入组到患者了。
这时候,芦可替尼的治疗优势已经显现:对照组出现了死亡,而芦可替尼治疗组“零死亡”。基于这样的情况,研究团队决定停止入组新的病人,完成对目前入组患者的治疗,并总结临床研究结果。
最后的分析中,发现研究达到了“CT结果改善”这个终点,让试验获得了成功。死亡率不是主要重点,因为试验人数不多,试验组和对照组没有达到显著差别,但是,芦可替尼治疗组的“零死亡”,应该是最大的看点和亮点!
回顾在中国开展的这个芦可替尼的临床试验,作为一个“研究者发起”的临床试验,因无法大规模招募患者,要获得成功的可能性不是很大。但是,由于芦可替尼的效果非常明显,虽然试验都没有按计划招满患者,最后只有41个患者的数据,但还是获得了成功。所以,这是一个非常幸运的临床试验。
值得一提的是,来自中科大的托珠单抗的治疗方案,所针对的也是细胞因子风暴,但是目前所报道的是早期试验的结果,所治疗的是21名患者,其中17名重症,4名危重症,在治疗后全都出院了,住院治疗时间范围为10~31天[8]。这也是一个不错的结果,也是“零死亡”,但是因为是早期试验,很遗憾没有对照组来作为参照,表明治疗使得死亡率“回零”了。
前面提到意大利也有一个出现“零死亡”的临床研究,使用的是抗GM-CSF受体单抗,同样是阻断细胞因子风暴的。根据单抗药物研发公司公布在其网站上的信息,该临床研究的对照组有26人,治疗组13人,在治疗14天后,对照组死亡率为27%,治疗组为0,结果也不错,但是需要等到论文正式发表才能证实。
在其他的临床试验中,疫苗的受试者都是健康人,而轻症新冠患者也不应该有严重后果,所以都不会涉及死亡率的问题。 只有涉及重症、危重症的治疗,死亡率才会成为一个指标。而新冠感染真正让人恐惧的,正是死亡率的问题,并不是感染率。所以,谁能把死亡率降下来,谁就是特效药。
目前芦可替尼、托珠单抗、抗GM-CSF抗体的临床结果可以相互印证,说明阻断免疫细胞因子风暴应该是一条正确的道路。
病毒是全人类的敌人,
人类只有合作,才能生存
没有国内的临床资源,黄刚教授的研究,只能在小老鼠身上反来复去地实验。
没有与黄刚的合作,面对新冠肺炎患者的周剑峰教授,也许只能试用其他的方案。所以说,芦可替尼的临床试验是中美华人科学家合作的典范。
这个研究是一个“研究者发起”的临床研究,也就是说,推动临床试验的人,是进行临床试验的研究者, 而不是生产药物的药企。 芦可替尼是Incyte公司研发的药物,但是由诺华负责美国以外的商业销售。
为了进行临床试验,周剑峰教授用研究经费,从诺华购买了300人份的试验用药。在提供临床用药之后,诺华一直在关注试验的进展。研究团队认为,研究的目的并不是为了发论文,而是为了救人,所以即便是论文还没有发表,也把一些数据提供给了诺华。
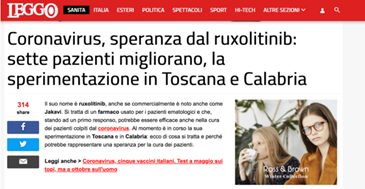
当疫情在意大利蔓延之后,诺华也牵线了意大利的医生,与周剑峰教授交流了临床使用芦可替尼来治疗新冠肺炎的经验。在意大利,芦可替尼的药名是Jakavi。根据意大利的新闻报道,当地已经有数名患者在用药之后,病情好转了。意大利的试验用药,是由诺华捐赠提供的。
基于中国的临床试验和意大利试药的结果,诺华和Incyte于4月3日宣布,将开始大规模的3期临床试验。clinicaltrials.gov 显示,目前全球有14个使用芦可替尼治疗新冠的临床试验正在进行。
如果说这是一场战争,黄刚和周剑峰的团队已经打完了自己的战争。下半场,只能由制药公司上场了,毕竟大公司有更多的资源,也能在千变万化的疫情中,入组疫情爆发点的患者进行试验。
芦可替尼在中国的临床试验中出现“零死亡”,在更大规模的临床试验中,是否能够大大减少重症患者的死亡率,甚至保持“零死亡”?这是大家都迫切想知道的。
基于目前的数据,诺华已经开始提供芦可替尼,作为“同情用药”使用(RuxolitinibManaged Access Program,MAP) 。新冠肺炎患者可以通过医生向诺华申请同情用药。
在新冠肺炎的治疗中,其实一直缺少的,是一个能够有效治疗重症患者的药,能减少重症的死亡,避免重症变成危重。
如今,芦可替尼就是一个希望!当然,芦可替尼不可能是神药,对于有免疫缺陷的人,芦可替尼可能还是无能为力。
但是对于绝大部分并不存在免疫缺陷问题的人,也许因为芦可替尼,就能把新冠降级为流感。
参考文献:
1.Xu, Z., et al., Pathological findings of COVID-19 associated with acute respiratorydistress syndrome. The Lancet Respiratory Medicine.
2.姚小红, et al., 新型冠状病毒肺炎(COVID-19)3例遗体多部位穿刺组织病理学研究. 中华病理学杂志, 2020. 49(2020-03-15).
3.Choy, E.H., Clinical significance of Janus Kinaseinhibitor selectivity. Rheumatology, 2018. 58(6): p. 953-962.
4.Wang, G.-S., et al.,JAK-STAT signaling pathway in pulmonaryarterial smooth muscle cells is activated by hypoxia. Cell biologyinternational, 2005. 29(7): p.598-603.
5.Chen, X., et al., Restoration of leukomonocyte counts isassociated with viral clearance in COVID-19 hospitalized patients. medRxiv,2020: p. 2020.03.03.20030437.
6.Liu, L., et al., Anti-spike IgG causes severe acute lunginjury by skewing macrophage responses during acute SARS-CoV infection. JCIInsight, 2019. 4(4).
7.Huang, R., et al., HIF1A is a critical downstream mediator forhemophagocytic lymphohistiocytosis. Haematologica, 2017. 102(11): p. 1956-1968.
8.Xu, X., et al., Effective treatment of severe COVID-19patients with tocilizumab. Proceedings of the National Academy of Sciences,2020. 117(20): p. 10970.
“特别声明:以上作品内容(包括在内的视频、图片或音频)为凤凰网旗下自媒体平台“大风号”用户上传并发布,本平台仅提供信息存储空间服务。
Notice: The content above (including the videos, pictures and audios if any) is uploaded and posted by the user of Dafeng Hao, which is a social media platform and merely provides information storage space services.”