首个国产新冠口服药公布III期结果!拟定价500元


独家抢先看
本文作者:No longer
近日,君实生物公布了 VV116 对比 PAXLOVID 早期治疗轻中度 COVID-19 的 III 期注册临床研究结果。
临床研究结果显示,VV116 用于轻中度 COVID-19 的早期治疗达到临床方案预设的主要终点。
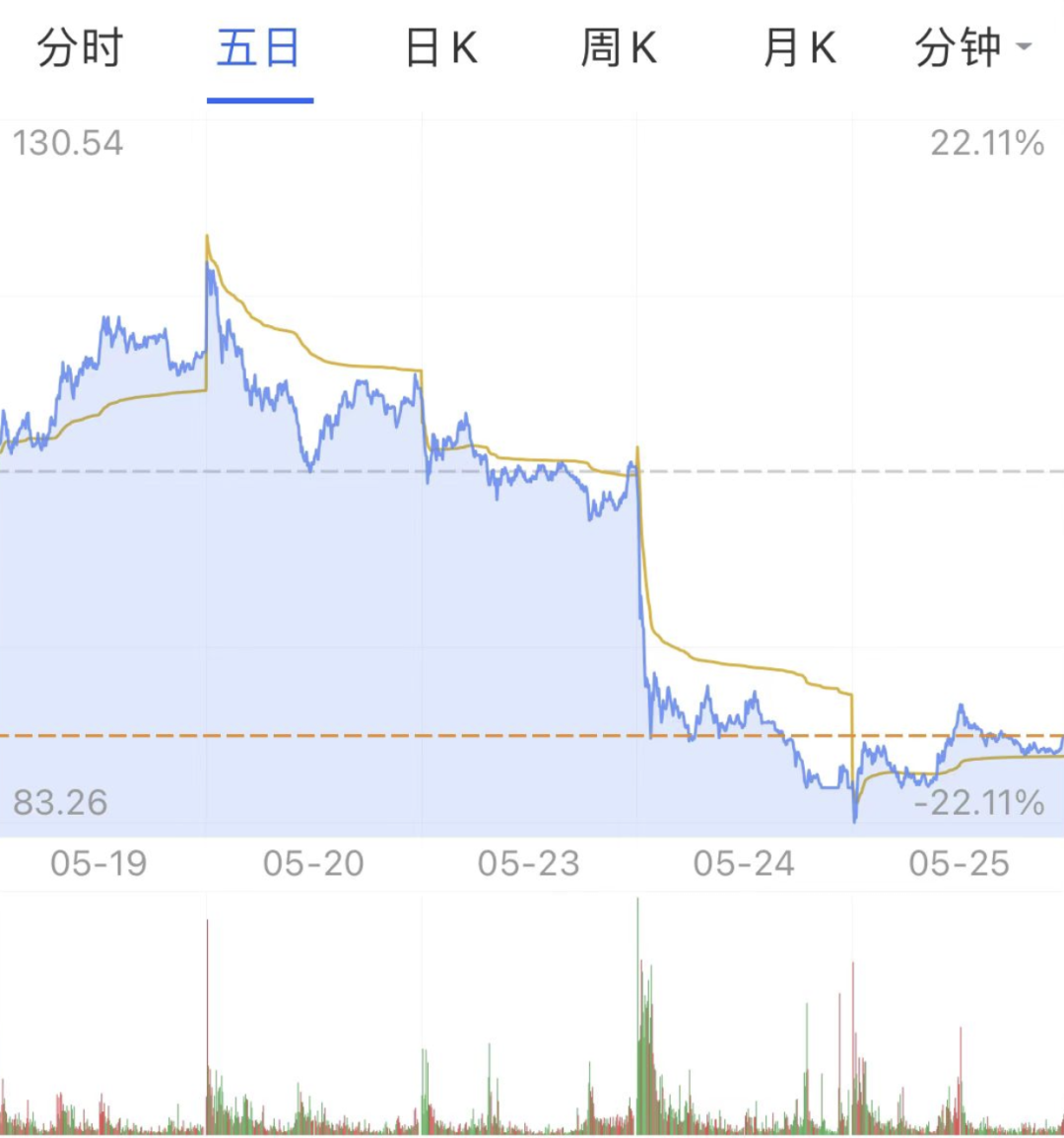
不过,就在公布 VV116 临床研究结果情况后的第二天,君实生物在科创板跌停。
图源:支付宝股票
一项利好的消息,怎么就造成了跌停?
首个国产抗新冠口服药
君实是最早布局新冠口服药的企业之一。
早在 2021 年 10 月,君实就宣布与旺山旺水达成合作,共同承担口服核苷类抗 SARS-CoV-2 候选药物 VV116 在全球范围内的临床开发和产业化工作。
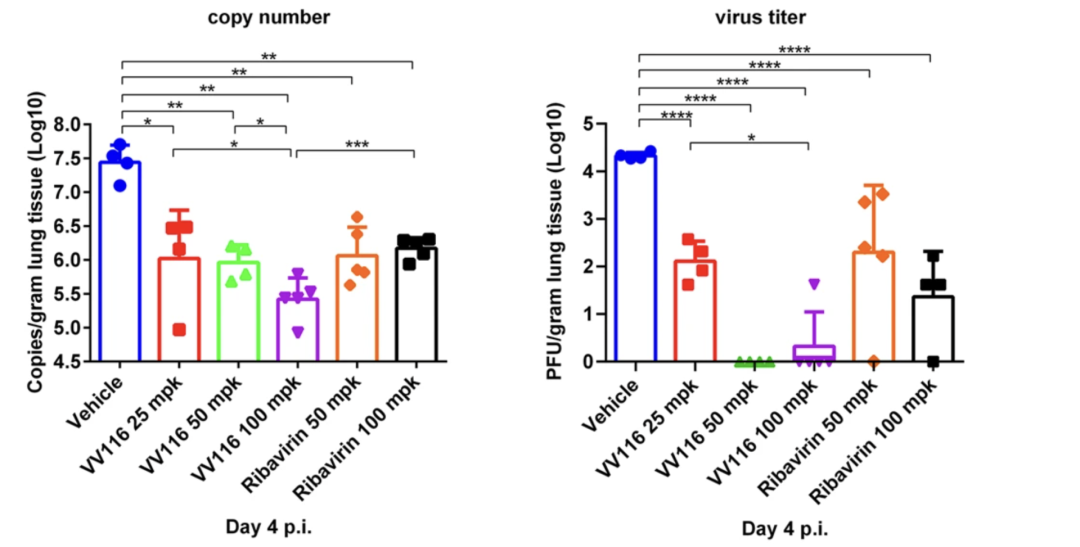
VV116 发表于 Cell Research 的一项临床前研究显示,VV116 在体内外都表现出显著的抗 SARS-CoV-2 病毒作用。 在小鼠模型上,VV116 和对照药 Molnupiravir 都可将新冠病毒滴度降低至检测限以下,二者均表现出较强的抗 SARS-CoV-2 的功效。
感染第 4 天后不同组别小鼠病毒滴度 图源:Cell Research
此外,临床前药代动力学还显示 VV116 具有很高的口服生物利用度,口服吸收后迅速代谢为母体核苷,能在体内组织广泛分布。
此后,君实启动了一系列临床试验。
2021 年,VV116 在乌兹别克斯坦完成了一项在中、重度新型冠状病毒肺炎受试者中进行的随机、开放、对照 II 期临床试验,研究结果显示,与对照组相比,VV116 组可以更好地改善患者的临床症状,缩短 SARS-CoV-2 核酸转阴时间,并显著降低进展为危重型及死亡的风险。
基于该试验的积极结果, VV116 已在乌兹别克斯坦获得批准用于中重度 COVID-19 患者的治疗,VV116 成了国内首个在海外批准上市的新冠口服药 。
2022 年 5 月 18 日,Emerging Microbes & Infections 杂志发表了一篇 VV116 针对奥密克戎变异株感染者的首个临床试验结果。
研究数据显示,在首次核酸检测阳性 5 日内使用 VV116 的奥密克戎感染患者,其核酸转阴时间为 8.56 天,小于对照组的 11.13 天。在本研究的用药时间范围内(首次核酸阳性 2~10 天)对有症状的患者中给予 VV116,均可以缩短患者的核酸转阴时间。
图源:Emerging Microbes & Infections
在药物安全性上,VV116 治疗组未观察到严重不良反应,共报告了 9 例不良事件,其中 7 例为轻度肝功能异常,所有不良事件无需干预即可缓解。
2022 年 5 月 23 日,君实宣布 VV116 对比 PAXLOVID 早期治疗轻中度 COVID-19 的 III 期注册临床研究达到主要研究终点。
图源:公司公告
从公告上来看,所有的试验结果都很棒,那么造成这次闪崩的原因可能是什么?
两点质疑
针对君实 5 月 23 日发布的公告,业内主要的质疑的有两点。
其一是单盲实验:医生知道病人使用的是 VV116 还是 Paxlovid,难以完全客观评判药物。
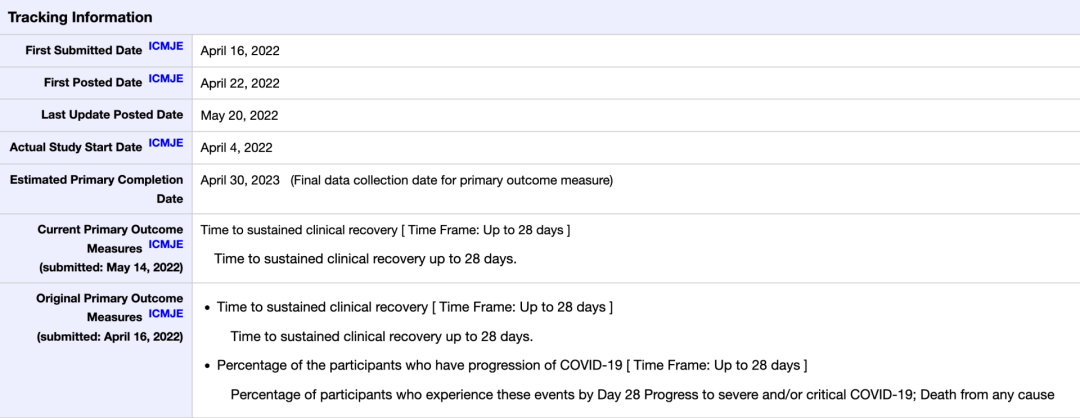
其二临床终点使用不当:君实生物的临床纳入标准是 ①新冠检测结果呈阳性 ②有一种或多种轻度或中度 COVID-19 症状 ③严重 COVID-19 高风险(包括死亡)患者;但唯一的主要临床终点是「至持续临床恢复的时间」。
此前,5 月 14 日,君实修改过临床终点,将 4 月 16 日时其中一个临床主要终点「转重症或死亡的比例」删除。
来源:clinicaltrials
针对此,跌停次日(也就是昨日),君实披露了进一步数据,对这一波质疑做出了回应。
在临床实验单盲方面,君实表示,该方案经与监管部门沟通后开展,单盲设计即在研究结束最终数据库锁定前,研究者(包括研究终点评估者)和申办方都不会知道具体的治疗药物分配情况。
在临床终点方面,君实采用的次要研究终点包括「截至第 28 天发生 COVID-19 进展(定义为进展为重度/危重 COVID-19 或全因死亡)的受试者百分比」、「至持续临床症状消失的时间」、「SARS-CoV-2 转阴的受试者百分比」等。
在次要有效性终点方面,VV116(JT001)组和 PAXLOVID 组均未发生 COVID-19 疾病进展及死亡。同时研究结果也显示,两组至持续临床症状消失时间,以及至首次 SARS-CoV-2 核酸转阴时间相似,相比于 PAXLOVID,VV116(JT001)组有统计学优效趋势。
在安全性方面,VV116(JT001)总体安全性良好,总体不良事件发生率低于 PAXLOVID。
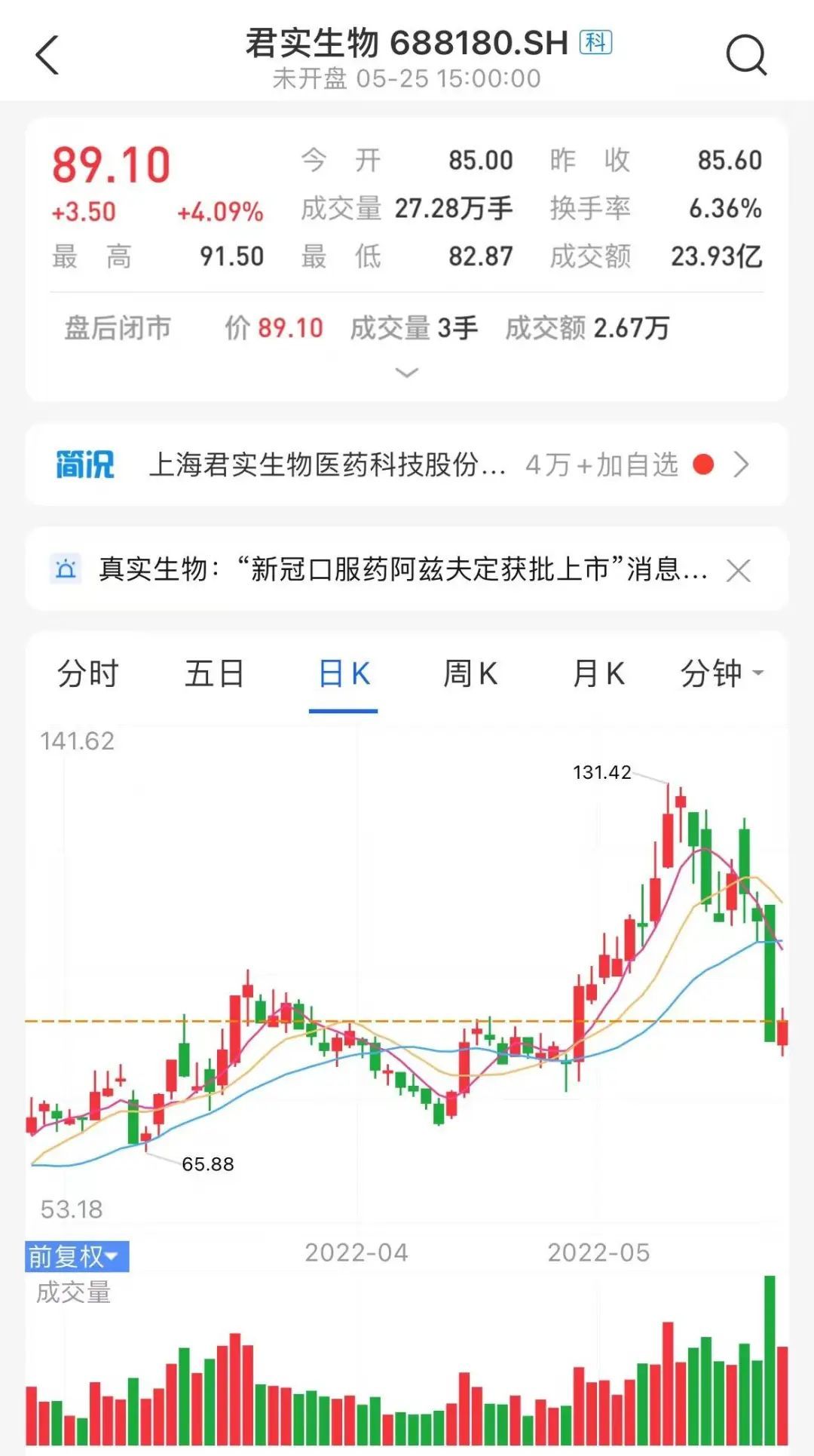
这份官方回应发布的当天,君实股价有一个 4.09% 的涨幅。
图源:支付宝股票
未来
25 日路演上,君实表示后续将递交 NDA(新药申请):「我们比较过,时间上与 EUA(美国 FDA 紧急使用授权) 不会有特别大的差异。并且 EUA 需要的数据其实不是特别齐备, 我们其实数据齐备的,药学早期已经提交审查了,前置条件上,我们拿到了 NDA 需要的东西,速度上 NDA 不会慢 。」
NDA 包括信息, 图源 study4rac
并表示,刚开始会定价 500 左右,未来会「往上亿级别去储备产能(一年如果有需要的话,我们会产生几亿人份的药物)」。
据悉,本月 10 日,在乌兹别克斯坦共和国创新发展部和中国科学院中亚药物研发中心/中乌医药科技城在乌国创新发展部新闻中心联合召开的的新闻发布会上,公布 Renmindevir 已在乌国上市,定价 185 美元,约合 1243 元人民币。
策划:carollero
监制:gyouza
题图来源:视觉中国
参考资料:
[1].https://www.nature.com/articles/s41392-022-00963-7
[2].https://clinicaltrials.gov/ct2/show/record/NCT05341609
[3].https://www.tandfonline.com/doi/full/10.1080/22221751.2022.2078230
[4].君实生物:关于VV116对比PAXLOVID早期治疗轻中度COVID-19的III期注册临床研究达到主要研究终点的公告
[5].Xie, Y., Yin, W., Zhang, Y. et al. Design and development of an oral remdesivir derivative VV116 against SARS-CoV-2. Cell Res 31, 1212–1214 (2021). https://doi.org/10.1038/s41422-021-00570-1
[6].上海君实生物医药科技股份有限公司 自愿披露关于VV116临床研究进展的公告
[7].Yinzhong Shen, Jingwen Ai, Na Lin, Haocheng Zhang, Yang Li, Hongyu Wang, Sen Wang, Zhen Wang, Tao Li, Feng Sun, Zhenyu Fan, Liqun Li, Yunfei Lu, Xianmin Meng, Hong Xiao, Huiliang Hu, Yun Ling, Feng Li, Hongdi Li, Chunmei Xi, Liping Gu, Wenhong Zhang & Xiaohong Fan (2022) An Open, Prospective Cohort Study of VV116 in Chinese Participants Infected with SARS-CoV-2 Omicron Variants, Emerging Microbes & Infections, DOI: 10.1080/22221751.2022.2078230
[8].https://study4rac.wordpress.com/page/2/
“特别声明:以上作品内容(包括在内的视频、图片或音频)为凤凰网旗下自媒体平台“大风号”用户上传并发布,本平台仅提供信息存储空间服务。
Notice: The content above (including the videos, pictures and audios if any) is uploaded and posted by the user of Dafeng Hao, which is a social media platform and merely provides information storage space services.”